Der Aufbau der Materie
Die Anfänge in der Antike
 Demokrit |
Bereits vor 2500 Jahren behauptete Demokrit (460-371 v. Chr., Abb.), dass alle Materie aus unteilbaren ("a tomos") Grundbausteinen zusammengesetzt sei. Von diesen Grundbausteinen sollte es nur eine kleine Anzahl unterschiedlicher Typen geben. Die verschiedenen Eigenschaften von Materie erklärte Demokrit aus der unterschiedlichen Anordnung und Kombination dieser Grundbausteine im leeren Raum. Diese Auffassung wurde von Aristoteles jedoch kritisiert, da er die Vorstellung eines leeren Raumes ablehnte. In Anlehnung an seinen Lehrer Platon erklärte er die Vielfalt der irdischen Erscheinungen stattdessen aus dem Zusammenwirken der Grundelemente Feuer, Wasser, Erde und Luft. In den folgenden 2000 Jahren sollte das Abendland hierin Aristoteles folgen, und der Atomismus blieb zunächst folgenlos. Ironischer Weise verdanken wir Aristoteles jedoch, dass die atomistischen Ideen überliefert wurden. Während nämlich alle Originalarbeiten Demokrits verloren gingen, wurde die Kritik von Aristoteles am Atomismus zur einzigen Quelle.
2000 Jahre später: Die Chemie entdeckt das Atom wieder
Die Renaissance des Atomismus begann in der 2. Hälfte des 18. Jhd. durch chemische Untersuchungen. Es zeigte sich, dass die vier aristotelischen Elemente (Feuer, Wasser, Erde, Luft) keineswegs die vielfältigen Naturerscheinungen erklären konnten. Bereits der französische Chemiker Antoine Lavoisier (1743-1794) unterschied 23 verschiedene Stoffe, von denen viele bereits den chemischen Elementen unserer Zeit entsprechen. Weiterhin beobachtete man die Mischung dieser Stoffe in charakteristischen Volumenverhältnissen. So ergibt sich etwa Wasser aus einem Volumenteil Sauerstoff und 2 Volumenteilen Wasserstoff (bei konstantem Druck und Temperatur). Diese Beobachtung erklärt sich zwanglos aus der Annahme, dass Sauerstoff und Wasserstoff bestimmten Atomen entsprechen, die sich im Verhältnis 2:1 zu Wasser verbinden.
Ordnung in der Welt der Atome: Das Periodensystem der Elemente
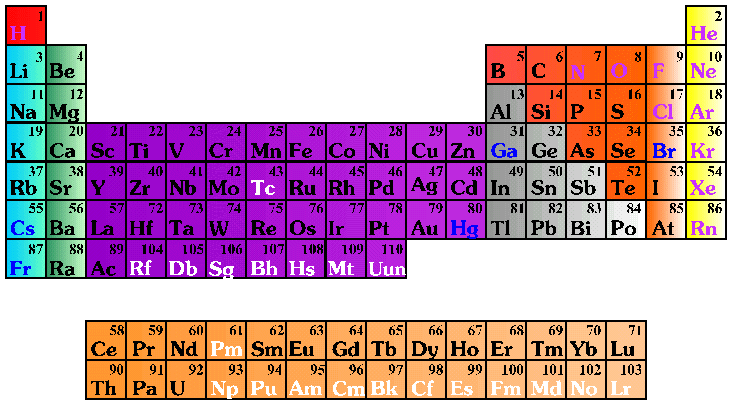
|
Das Periodensystem der Elemente. Durch Anklicken erhält man ein größeres Bild. |
Durch die Entdeckung immer neuer Atome entfernte sich die Atomtheorie jedoch vom ursprünglichen Ziel, die verschiedenen Eigenschaften der Stoffe auf wenige Grundelemente zurückzuführen und damit zu erklären. Mitte des 19. Jhd. waren schon ca. 60 verschiedene chemische Elemente bekannt. Heutzutage kennt man weit über 100. Eine Begründung ihrer verschiedenen Eigenschaften durch die Annahme ihres Aufbaus aus verschiedenen Atomen bedeutete aber nicht mehr als die Feststellung, dass es eben verschiedene Formen der Materie gibt.
Diese zahlreichen Atome standen jedoch nicht beziehungslos nebeneinander. Meyer und Medelejew gelang es 1868/69 unabhängig voneinander diese Elemente in ein Ordnungsschema einzufügen. Das sog. Periodensystem der Elemente (Abb.) ordnet die Elemente nach ihren Eigenschaften und erlaubte sogar die Vorhersage von zu diesem Zeitpunkt noch unbekannten Elementen. Rückblickend ist diese Ordnungsstruktur unter den Atomen der erste Hinweis darauf, dass diese Ihrerseits aus Bausteinen zusammengesetzt sind.
Atomtheorie und Physik
Neben diesen chemischen Untersuchungen, die die Umwandlung von Stoffen betrachteten, trug auch die physikalische Forschung seit Anfang des 19. Jhd. zur Entwicklung der Atomtheorie bei. Hier ist vor allem die Theorie der Wärme zu nennen. Diese führte durch Arbeiten von Dalton und später Maxwell und Boltzmann zur sog. "kinetischen Gastheorie", nach der die Eigenschaften eines Gases auf die Bewegung kleiner Materieteilchen zurückgeführt werden. Diese wurden schließlich mit den Atomen identifiziert. Allerdings setzte sich die Atomtheorie der Materie erst im Laufe des 19. Jhd. durch, und der bedeutende Physiker Ernst Mach (1838-1916) hielt sie noch am Ende des 19.Jhd. für metaphysischen Unsinn. Eine einflussreiche Auseinandersetzung zwischen Anhängern und Gegnern dieser Theorie fand auf der Naturforscherversammlung am 17.9.1895 in Lübeck statt. Hier behielten die Anhänger der Atomtheorie die Oberhand.
In das Innere der Atome
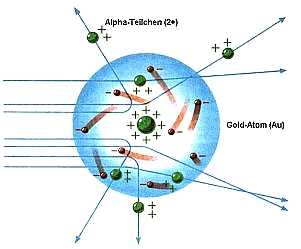
|
Schematische Darstellung des Streuexperiments von Rutherford. |
Zur selben Zeit kam es zur Entdeckung neuer Strahlungsphänomene durch Röntgen (1895, Röntgenstrahlung, d.h. hochenergetische elektromagnetische Strahlung), Becquerel (1896, "Uranstrahlung", d.h. radioaktive alpha-Strahlung ) und J. J. Thompson ("Kathodenstrahlung", d.h. Elektronenstrahlung). Diese Entdeckung hat eine doppelte Bedeutung für das was später Atom und Kernphysik genannt wurde: Zum Einen ist ihre Erklärung nur innerhalb dieser Theorien möglich, zum Anderen eröffneten sie neue experimentelle Methoden zur Untersuchung der Atome. Das berühmte Rutherford Experiment von 1911, das in der Abbildung dargestellt ist, liefert dafür ein gutes Beispiel. Rutherford untersuchte Goldfolie mit Hilfe von alpha-Strahlung. Die charakteristische Form der Ablenkung der positiv geladenen alpha-Teilchen (Heliumkerne) an Goldatomen zeigte, dass im Inneren von Atomen ein sehr kleiner positiv geladener Kern existiert. Dieser Kern ist von Elektronen umgeben. Nur wenige Zeit später wurde dieser Kern als aus Protonen zusammengesetzt erkannt, und 1932 wurde durch Chadwick noch ein elektrisch neutrales Teilchen im Atomkern entdeckt, das Neutron.
Die Suche geht weiter: Leptonen, Quarks & Co.
Nicht wenige Physiker waren in den 30er Jahren davon überzeugt, dass mit Elektron, Proton und Neutron die "tatsächlichen" Atome, also unteilbare Grundbausteine der Materie, entdeckt seien. Parallel dazu entwickelte sich mit der Quantentheorie eine erfolgreiche theoretische Beschreibung der Atomphysik. Dadurch war es etwa möglich, den Aufbau des Periodensystems der Elemente aus der Theorie des Atombaus abzuleiten.
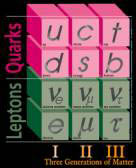
|
Die drei Generationen der Materiebausteine. |
Im Licht der heutigen Erkenntnis ist das Elektron tatsächlich elementar, d.h. strukturlos. Proton und Neutron erwiesen sich jedoch ihrerseits als zusammengesetzt. Ihre Bausteine werden Quarks genannt. Von diesen Quarks gibt es 6 unterschiedliche Typen. Das Elektron besitzt ebenfalls noch Verwandte, d.h. Teilchen die sich im Wesentlichen nur durch ihre Masse vom Elektron unterscheiden, man nennt sie Myon und Tau. Zusammen mit den 3 Neutrinos (ungeladenen und fast masselosen Teilchen) bilden diese 6 Teilchen die Gruppe der Leptonen.
Das neue "Periodensystem der Elemente", also die Liste der fundamentalen Materiebausteine hat damit die folgende Gestalt:
Die Unterscheidung zwischen Quarks und Leptonen ist dabei nur verständlich, wenn man nicht nur die Materiebausteine betrachtet, sondern zusätzlich die Kräfte die zwischen ihnen wirksam sind.
Zusammenfassung
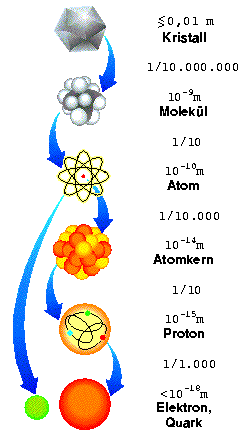
|
Schematische Darstellung des Materieaufbaus. Durch Anklicken startet man eine Animation zur Reise in die Materie! |
Diese Abbildung (Durch anklicken startet man eine Animation zur Reise durch die Materie) illustriert noch einmal die aktuelle Vorstellung über den Aufbau der Materie vom sichtbaren Kristall bis zu den elementaren Quarks und Leptonen. Die Unzahl von Molekülen besteht aus Atomen, von denen es 114 verschiedene gibt. Diese unterscheiden sich durch die Anzahl von Protonen und Neutronen im Kern sowie durch die Anzahl an Elektronen in der Hülle. Während diese Elektronen nach heutigen Verständnis elementar sind, bestehen Proton und Neutron aus je 3 Quarks. Man beachte die gewaltigen Größenunterschiede: Der Atomkern ist etwa 10000 mal kleiner als das Atom. Im Wesentlichen bestehen Atome aus Nichts.